小知识
费米黄金法则(Fermi’s golden rule)
应用实例:
(1) 根据费米黄金定则,Pr3+4f5d的辐射跃迁寿命比Ce3+5d短,理论预测Pr3+4f5d的辐射跃迁寿命最短可达~6 ns,使得Pr3+成为快响应闪烁体更有优势的候选发光中心离子。参考:真空紫外光及X射线激发下Pr3+掺杂Ba3La(PO4)3 发光性质。Analysis of the radiative lifetime of Pr3+ d-f emission
波尔原子光谱模型存在的问题之一就是it couldn't predict that one spectral line would be brighter than another. From the quantum theory came an explanation in terms of wavefunctions, and for situations where the transition probability is constant in time, it is usually expressed in a relationship called Fermi's golden rule.
In general conceptual terms, a transition rate depends upon the strength of the coupling between the initial and final state of a system and upon the number of ways the transition can happen (i.e., the density of the final states). In many physical situations the transition probability is of the form. $$\lambda_{i f}=\frac{2 \pi}{\hbar}\left|M_{i f}\right|^{2} \rho_{f}$$描述:
(1) 下标\(i\)表示initial state,下标\(f\)表示final state。
(2) \(\rho_{f}\)表示density of final states。同一能量不同的状态数(简并态),另外This degeneracy is sometimes expressed as a "statistical weight" which will appear as a factor in the transition probability. In many cases there will be a continuum of final states, so that this density of final states is expressed as a function of energy \(\rho_{f}(E)\)。
(3) \(M_{i f}\)表示matrix element for the interaction。
(4) transition probability \( \)也叫作decay probability或者说decay constant,对应于该state的平均lifetime by \( \lambda = 1/\tau\)。
(5) 费米黄金法则的general form也可以apply to atomic transition,nuclear decay,scattering等等a large variety of physical transitions。
$$M_{i f}=\int \Psi_{f}^{*} V \Psi_{i} d v$$描述:
(1) \(\Psi_{i}\)表示wavefunction for initial state。
(2) \(\Psi_{f}\)表示wavefunction for initial state,右上角的星号表示转置共轭。
(3) \(V\)表示operator for the physical interaction which couples the initial and final states of the system.
用来计算单位时间内一个波函数从一个态变化到另一个态的概率
应用:
(1) Analysis of the radiative lifetime of Pr3+ d-f emission
对话
A: 特定跃迁的吸收峰,随着温度的升高是会展宽吧,也就是说,半高宽变大,变矮胖?
B: 会展宽,但是面积不变。
A: 这是啥原理?
B: 跃迁前后电子的布局(population)服从玻尔兹曼分布。
A: 温度只是导致了分布的不同而已?
B: 嗯。
A: 中心位置不变?
B: 嗯,只是分布在两边的不同振动态的电子比例变了。
A: 那吸收峰面积的物理意义是啥?
B: 面积表示的就是跃迁的强度啊,振子强度和跃迁偶极矩成正比关系。
A: 那这个和温度无关吗?
B: 嗯,根据费米黄金法则,跃迁过程与温度无关。
参考资料:
(1) Transition Probabilities and Fermi's Golden Rule-hyperphysics
(2) 如何理解如何理解费米黄金定则?
(3) Fermi's Golden Rule Explained - Two-Level Systems
(3) 费米黄金定律与量子点-知乎
(4) 费米黄金规则 Fermi's Golden Rule-知乎
(5) 费米黄金规则-知乎
卡莎规则
卡莎规则(Kasha's rule):是光化学中有关激发态分子的重要原理。卡莎规则指出,对于多重态的分子,光子仅能由最低激发态发射。此光子可以以荧光或者磷光的形式发射。 因此,发射光的波长和激发光的波长无关。
卡莎规则的一个推论是【Vavilov rule】,which states that the quantum yield of luminescence is generally independent of the excitation wavelength. This can be understood as a consequence of the tendency – implied by Kasha's rule – for molecules in upper states to relax to the lowest excited state non-radiatively. Again there are exceptions: for example benzene vapour. (注:Vavilov为俄罗斯物理学家Sergey Ivanovich Vavilov,也是P.P. Feofilov的导师)
参考资料:
(1) 幽灵与捉鬼者:Kasha's rule七十周年
(2) 什么是卡莎法则?卡莎是谁?
(3) Kasha's rule-Wiki
分子电子跃迁
(1) 表示分子中价电子从一个能级因为吸收能量时,跃迁到一个更高的能级;或者释放能量,跃迁到更低的能级的过程;
(2) 释放与吸收的能量等于这两个能级的能量之差;
(3) 在此过程中的能量变化提供了分子结构的信息,并决定了许多分子性质如颜色;
(4) 一般,我们应用电子跃迁来说明单个原子。当讨论多原子分子时,我们应用分子轨道理论。也可以视单个原子为单原子分子,将各种情况的电子跃迁统一到分子电子跃迁的框架下来。这里的能级是基于分子轨道理论提出的;
(5) 有机化合物中的电子跃迁在电磁频谱的紫外区或可见光区发生,可以由UV/VIS光谱测得。在HOMO σ带处的电子可被激发到 LUMO 的σ带。这个过程被写作σ → σ*跃迁。同样有电子从π键轨道激发至反π键轨道π*,写作π → π*跃迁。。助色基团的自由电子对被写为孤对电子n,孤电子对有自己的跃迁,如芳香π键跃迁。(参考维基百科的对应词条)
弗兰克-康登原理(镜像)
是光谱学的重要原理,用于解释电子-振动跃迁的强度。电子-振动跃迁指分子吸收或发射光子后,电子能级和振动能级同时发生变化的过程。Franck-Condon原理指出,在分子电子跃迁过程中,当两个振动能级(分别属于不同的电子能级)的波函数有效重叠程度最大时,这两个振动能级之间的跃迁发生的概率最大。此原理可以被量子力学所解释。
弗兰克提出:因为电子跃迁(飞秒量级10-15 s)与核运动(皮秒量级10-12 s)的时间尺度相比基本上是瞬时的,所以分子如果在电子跃迁期间移动到新的振动能级,这个新振动能级的核位置和动量须立即与原电子态的分子振动能级兼容。
弗兰克-康登原理在吸收和荧光方面的适用性以及卡莎规则,导致了如图所示的近似镜像对称性。
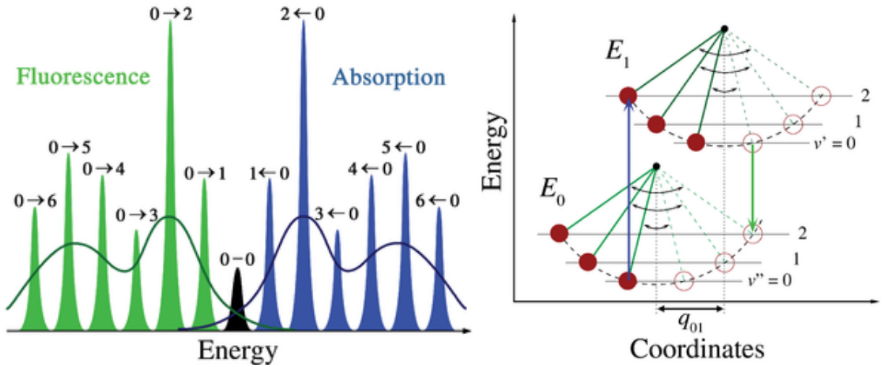
- 由于没有个别跃迁的不均匀加宽,分子在冷而稀疏的气体中的振动结构最为明显。
- 振动跃迁是窄的等间距洛伦兹线,振动能级之间的等间距仅适用于简谐振子的抛物线势,更真实的势中,能量间距随振动能量的增加而减小,比如莫尔斯势。
- 从最低振动态到最低振动态的电子跃迁通常被称为0-0 (zero - zero)跃迁,并且在吸收和荧光中具有相同的能量,这就是ZPL。
- 荧光发射是光吸收的逆过程。荧光发射光谱与吸收光谱有类似镜影的关系。但当激发态的构型与基态的构型相差很大时, 荧光发射光谱将明显不同于该化合物的吸收光谱。荧光粉的差别较大!
- 若考虑最简单的双原子分子情形,则核坐标轴指的是核间分离。
- Semiclassical pendulum analogy of the Franck–Condon principle. Vibronic transitions are allowed at the classical turning points because both the momentum and the nuclear coordinates correspond in the two represented energy levels. In this illustration, the 0–2 vibrational transitions are favored.
声子的弗兰克-康登原理
最接近的弗兰克-康登类比:“发色团作为杂质嵌入晶格中,而声子(晶格振动的量子)会与发色团的电子跃迁产生交互作用。”在这种情况下,当光子的能量对应于纯电子跃迁能量,或对应于纯电子跃迁能量加上一个或多个晶格声子的能量时,就会发生跃迁到更高的电子能级。在低温近似中,发射跃迁是从激发态的零声子能级到基态的零声子能级或基态的高声子能级。图中晶格模式\( q_{i}\)的势能表示为谐振子的势能,而声子能级之间的间距(\(\hbar \Omega_{i}\))由晶格参数确定。因为单个声子的能量通常非常小,所以只能在低于约40 开尔文的温度下观察到零或几个声子跃迁。

沿着位形坐标\( q_{i}\),与声子耦合的电子跃迁能量图,这是晶格的简正模。 向上箭头表示没有声子和吸收三个声子的情形。向下箭头则表示发射的对称过程。
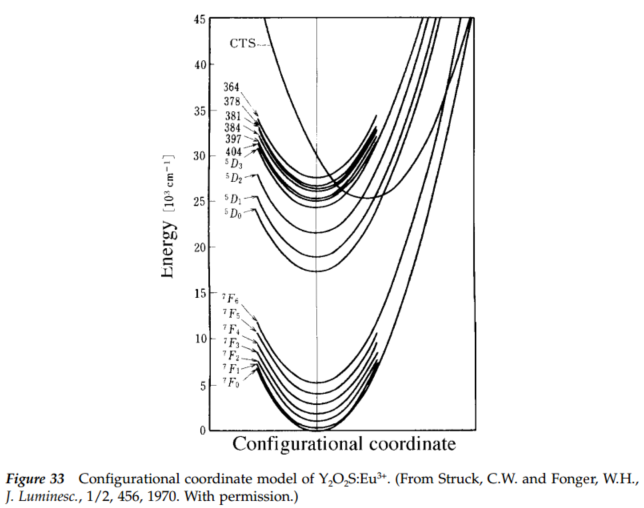
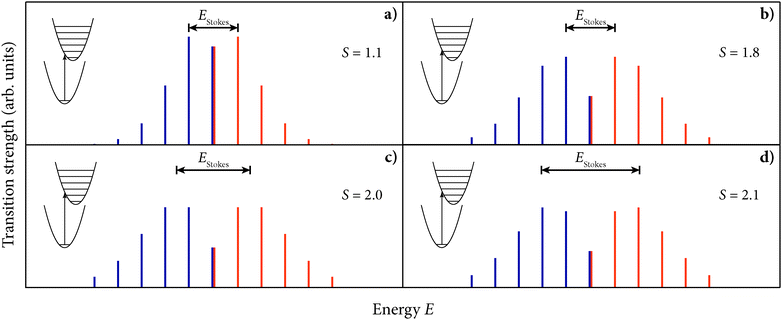
Frank-Condon shift:在Phosphor Handbook中提到了Frank-Condon shift的概念,其实就是平衡位置的移动距离,对于CTS来说,由于价态变化导致了离子半径的变化(更准确的说法是中心离子和配体离子之间距离的变化),这种变化往往比较大,反应在下图就是Frank-Condon shift比较大。书中写的是CTS is characterized by a fairly large Frank-Condon shift.
Franck–Condon overlap factor:The figure shows how in an electronic transition on the central ion there can be a change in the vibrational state, making a variety of combined electronic and vibrational (vibronic) transitions possible. The resulting spectrum exhibits fine structure consisting of lines corresponding to the different vibronic transitions. The relative intensities of these lines, corresponding to transitions between initial state with vibrational quantum number \(m\) and final state with vibrational quantum number \(n\), are given by the square of the overlap of the vibrational wavefunctions \(\left|\int \psi_{m}^{*} \psi_{n} \mathrm{~d} Q\right|^{2}\), commonly known as the Franck– Condon overlap factor.
A more thorough analysis to determine the position of the band maxima takes the overlap integral of the vibrational wavefunctions as a starting point. For the case that the electronic ground and excited states have equal vibrational energy \(\hbar \omega\), Keil has shown that the overlap integrals squared reduce to $$F_{n}^{m}=\left|\int \psi_{m}{ }^{*} \psi_{n} \mathrm{~d} Q\right|^{2}=\mathrm{e}^{-S} S^{n-m}\left(\frac{m !}{n !}\right)\left(L_{m}^{n-m}(S)\right)^{2}$$where \(L_{m}^{n-m}\) m are the associated Laguerre polynomials. This equation is symmetric in \(m\) and \(n\). Consequently, the absorption and emission bands are mirror images of each other with the zero-phonon line (\( m = 0\) and \(n = 0\)) as the mirror plane. The Stokes shift is twice the difference between the zero-phonon line and the maximum of the absorption or emission band: \(E_{\text {Stokes }}=2 E_{\max } \).
注:
(1) 上面提到了洛伦兹线,可以参考这里三种光谱线型函数
(2) 关于什么是简正模,可以看量子力学笔记的谐振子-代数法这一章节
Mirror–Image Relationship在荧光粉中的应用
发光材料的吸收光谱形状和发射谱相似,有的是带状谱,有的是线状谱。在溶液中的发光分子的吸收光谱和发射光谱常常是对称的(横轴为频率),因为这时吸收和发射都在同一个分子发生。但是在固体中,这两种光谱则不存在这样的关系,因为吸收的物质可能是基质,而发射的主体则是离子或离子团,两者的谱图可以完全没有直接的关系。(引入文献具体谈,有的用的不对,参考固体发光讲义-许少鸿)
有的文献中采用横轴为波长单位下的镜像,这是错误的处理方法。
(1)

Using the mirror–image relationship, we found absorption energy 2.54 eV. The Stokes shift can be calculated as 0.16 eV. 注意我还是有点迷惑怎么用的镜像,因为低温发射光谱是已知的,难道是利用发射谱和大的激发谱的intersection来确定ZPL,继而确定右侧镜像的位置?参考文献Luminescent characterization of CaAl2S4:Eu powder-JL-2007
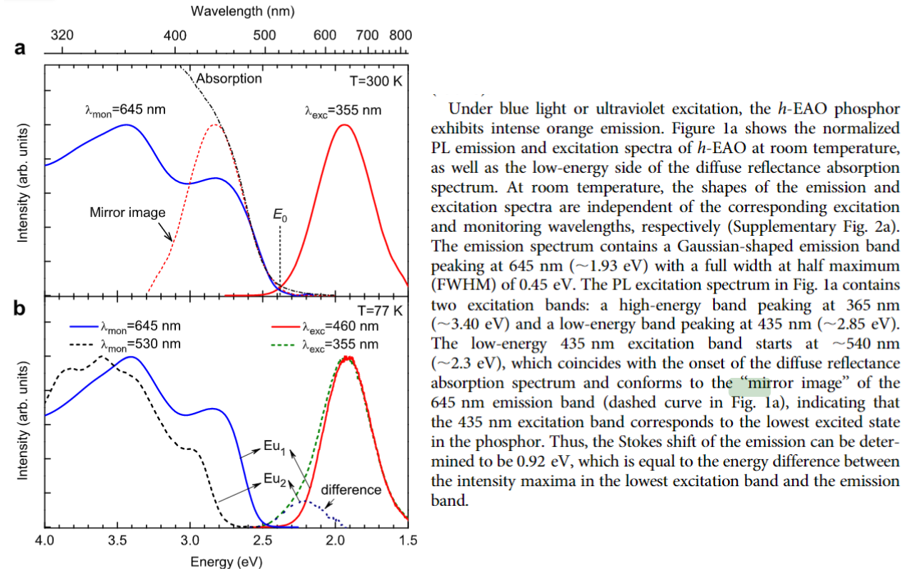
(2) 这里采用能量坐标,而且强度归一化,应该是对的吧?参考文献 New localized/delocalized emittingstate of Eu2+ in orange-emittinghexagonal EuAl2O4
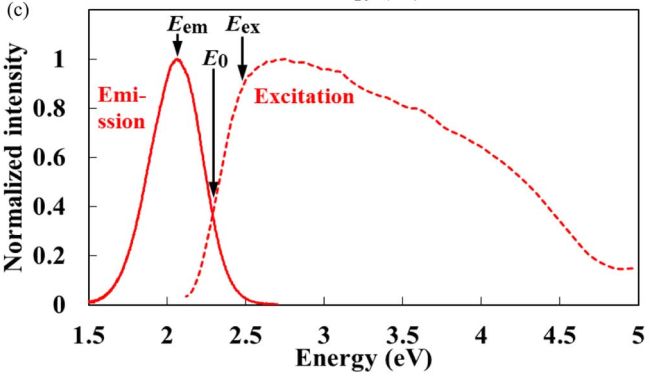
(3) 这里作者并没有说是低温下测试的结果,但是同样用归一化的激发发射来确定ZPL和Eex的位置,来自文献Thermal Quenching Analyses of Eu2+-Activated Sr-Containing Sialon Phosphors Using the Thermally Activated Cross-Over Model
(4) 还可以参考Resolving the ambiguity in the relation between Stokes shift and Huang–Rhys parameter-PCCP
姜-泰勒效应
在固体或者分子中,在一定对称性环境下的发光离子的某些简并的电子态会由于周围离子的振动使对称性发生变化而发生退简并,这就是Jahn-Teller效应。比如中心离子X处于Oh对称位置,由于周围六个离子M的振动,使垂直轴上的两个键伸长,同时平面上的四个键缩短,从而使对称性降低,由Oh变为D4h。这时原来在Oh对称下仍旧简并的态将进一步退简并。还应该考虑到, 配位离子的振动模式并不止一种。能够引起对称性变化的模式可能很多,而它们的对称性多 半不一样。这样一来,从光谱测量结果去分析Jahn-Teller 效应就不那么简单了。(参考 《固体发光讲义-许少鸿》P27)
位型坐标图往往只考虑一种vibrational coordinate,给出的是gross detail of the crossings and relative positions of the electronic levels,如果想知道fine details比如Jahn-Tellen distortions,那么需要several vibrational coordinates(振动坐标)。
参考资料:
(1) 什么是 Jahn-Teller 效应?-知乎
(2) Configuration coordinate energy level diagrams of intervalence and metal-to-metal charge transfer states of dopant pairs in solids-PCCP
雅布隆斯基图(Jablonski diagram)

参考资料:
(1) What is a Jablonski Diagram (Perrin-Jablonski Diagram)?-Edinburgh Instruments
In molecular spectroscopy, a Jablonski diagram is a diagram that illustrates the electronic states of a molecule and the transitions between them. The states are arranged vertically by energy and grouped horizontally by spin multiplicity. Nonradiative transitions are indicated by squiggly arrows and radiative transitions by straight arrows. The vibrational ground states of each electronic state are indicated with thick lines, the higher vibrational states with thinner lines. The diagram is named after the Polish physicist Aleksander Jabłoński.
拉波特规则
拉波特规则:Laporte rule是一种仅适用于中心对称分子或原子的光谱选律,可以表述为:相同原子轨道(例如s-s,p-p,d-d或f-f)之间的跃迁是禁阻的。此规则也可表述为:宇称不变或保留相对于反演中心的对称性的跃迁是禁阻的,即跃迁前后电子所在轨道的对称性不能均为对称(g)或均为反对称(u)。此类分子中允许的跃迁必须涉及宇称的变化,即g→u或u→g。[1]
符号g表示相对于反演中心对称,意即:如果分子中的所有原子都关于反演中心进行反转,那么反转后的轨道与反转前完全一样(包括空间取向相同)。符号u意味着轨道相对于反演中心是反对称的,在反演后各处都会改变符号。该规则源于量子力学选律:电子跃迁期间,宇称应反转。
但是,如果分子的对称中心被破坏,则允许进行禁阻跃迁,实际上,在实验中观察到了这种明显禁阻的跃迁。对称中心的破坏由于各种原因而发生,例如姜-泰勒效应和不对称振动。分子并非始终都是完全对称的,由于分子的不对称振动而发生的跃迁称为振动跃迁,例如由非绝热耦合引起的跃迁。通过这样的非对称振动,理论上禁阻的跃迁(例如d→d跃迁)被弱允许了。[2]
该规则以奥托·拉波特的名字命名[3],与过渡金属的电子光谱有着密切关系。八面体络合物具有对称中心,故根据该规则,d→d跃迁是禁阻的,且实际观察到其吸收非常弱。但是,四面体络合物没有对称中心,因此拉波特规则不适用,光谱吸收较八面体络合物更强。
Latva’s Rule
Breaking Latva’s Rule by Energy Hopping in a Tb(III):ZnAl2O4 Nanospinel
Atomic Spectroscopy和Molecular Spectroscopy辨析
原子光谱
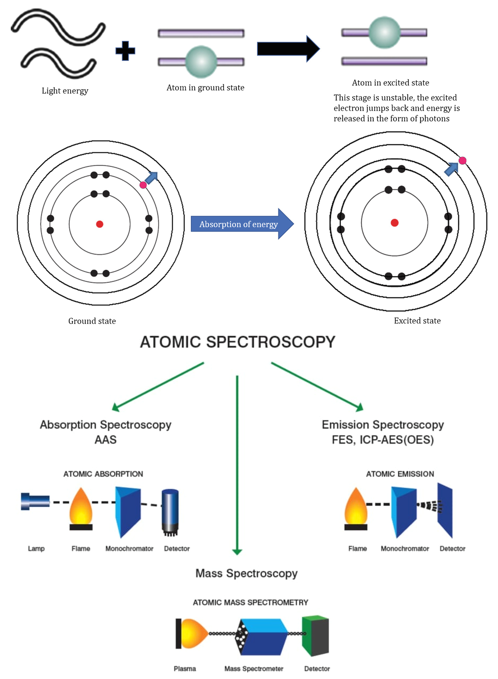 原子吸收光谱法 (AAS)是利用气态原子可以吸收一定波长的光辐射,使原子中外层的电子从基态跃迁到激发态的现象而建立的。由于各种原子中电子的能级不同,将有选择性地共振吸收一定波长的辐射光,这个共振吸收波长恰好等于该原子受激发后发射光谱的波长。当光源发射的某一特征波长的光通过原子蒸气时,即入射辐射的频率等于原子中的电子由基态跃迁到较高能态(一般情况下都是第一激发态)所需要的能量频率时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光减弱。
原子吸收光谱法 (AAS)是利用气态原子可以吸收一定波长的光辐射,使原子中外层的电子从基态跃迁到激发态的现象而建立的。由于各种原子中电子的能级不同,将有选择性地共振吸收一定波长的辐射光,这个共振吸收波长恰好等于该原子受激发后发射光谱的波长。当光源发射的某一特征波长的光通过原子蒸气时,即入射辐射的频率等于原子中的电子由基态跃迁到较高能态(一般情况下都是第一激发态)所需要的能量频率时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光减弱。
由于原子能级是量子化的,因此,在所有的情况下,原子对辐射的吸收都是有选择性的。由于各元素的原子结构和外层电子的排布不同,元素从基态跃迁至第一激发态时吸收的能量不同,因而各元素的共振吸收线具有不同的特征。由此可作为元素定性的依据,而吸收辐射的强度可作为定量的依据。AAS现已成为无机元素定量分析应用最广泛的一种分析方法。该法主要适用样品中微量及痕量组分分析。
实现原子化的方法,最常用的有两种:火焰原子化法:是原子光谱分析中最早使用的原子化方法,至今仍在广泛地被应用;非火焰原子化法,其中应用最广的是石墨炉电热原子化法。
分子光谱
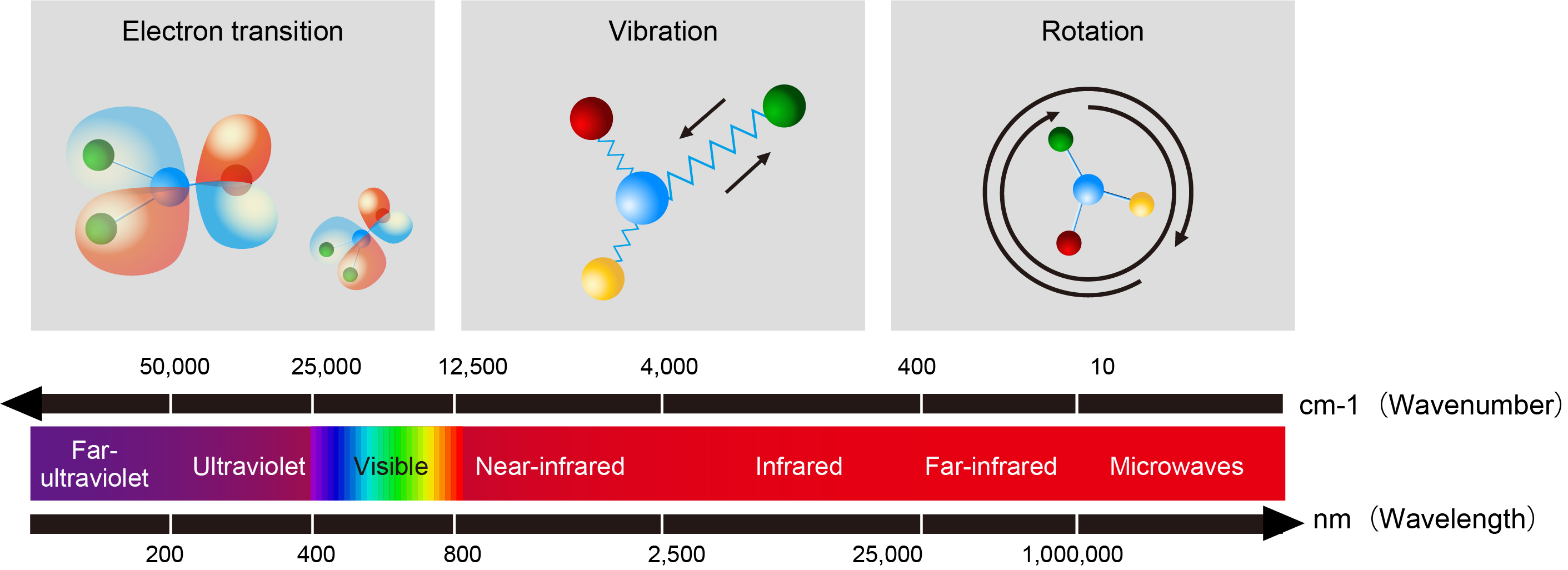 分子从一种能态改变到另一种能态时的吸收或发射光谱(可包括从紫外到远红外直至微波谱)。分子光谱与分子绕轴的转动、分子中原子在平衡位置的振动和分子内电子的跃迁相对应。
分子从一种能态改变到另一种能态时的吸收或发射光谱(可包括从紫外到远红外直至微波谱)。分子光谱与分子绕轴的转动、分子中原子在平衡位置的振动和分子内电子的跃迁相对应。
对比
原子光谱的特征是线状光谱,一个线系中各谱线间隔都较大,只在接近线系极限处越来越密,该处强度也较弱;若原子外层电子数目较少,谱线系也为数不多。
分子光谱的一般分布与原子光谱不同,许多谱线形成一段一段的密集区域成为连续带状,称为光谱带.所以分子光谱的特征是带光谱.它的波长分布范围很广,可出现在远红外区(波长是 cm 或 mm 数量级)、近红外区(波长是 μm 数量级)、可见区和紫外区(波长约在 10-1μm 数量级).分子光谱一般具有如下规律:(1)由光谱线组成光谱带;(2)几个光谱带组成一个光谱带组;(3)几个光谱带组组成分子光谱。
原子光谱法是由原子外层或内层电子能及的变化产生的,他的表现形式为线光谱。属于这类分析方法的有,原子发射光谱法(AES),原子吸收光谱法(AAS),原子荧光光谱法(AFS)以及以X射线荧光光谱法(XFS或XRF)。
分子光谱法是由分子中电子能级,振动和转动能级的变化产生的,表现为带光谱。属于这类分析方法的有,紫外可见分光光度法(UV-Vis),红外光谱法(IR)分子荧光光谱法(MFS)和分子磷光光谱法(MPS),核磁共振(NMR)与顺磁共振波谱(EPR)等。
参考资料:
(1) 分子光谱(百度百科)
(2) 原子光谱(百度百科)
(2) 分子光谱与原子光谱区别?(小木虫)
Luminescence/Photoluminescence/Fluorescence/Phosphorescence辨析
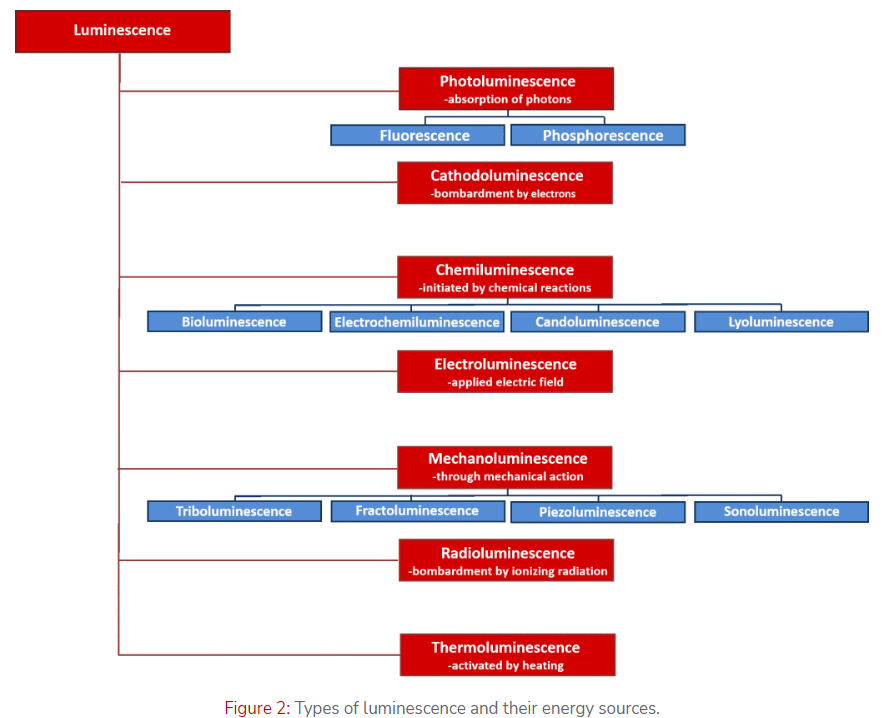
Luminescence: Luminescence is any emission of light (electromagnetic waves) from a substance that does not arise from heating. This definition makes luminescence distinct from incandescence which is light emission due to the elevated temperature of a substance, such as a glowing hot ember. The word luminescence is derived from the Latin word for light, lumen, and the Latin, escentia, meaning ‘the process of’ and hence is the process of giving off light.
Photoluminescence: Photoluminescence is the emission of light from a material following the absorption of light. The word in itself is interesting in that it the combination of the Latin derived word luminescence and the Greek prefix, photo-, for light. Any luminescence that is induced by the absorption of photons is called photoluminescence. This could equally be light emission from an organic dye molecule in solution, or band-to-band recombination of electrons and holes following photoexcitation of a semiconductor.
Describing any photon absorption induced light emission as photoluminescence is accurate; however, it is common practice, particularly by chemists, to further subdivide photoluminescence into fluorescence and phosphorescence.
Fluorescence/Phosphorescence: fluorescence is prompt photoluminescence that occurs very shortly after photoexcitation of a substance, while phosphorescence is long-lived photoluminescence that continues long after the photoexcitation has ceased.
Fluorescence/Phosphorescence (A more thorough definition has to be based on the quantum mechanics of excited and ground states involved in the emission process): fluorescence and phosphorescence can be defined as photoluminescence where the radiative transition does not require a change in spin multiplicity and photoluminescence where the radiative transition involves a change in spin multiplicity respectively.
参考资料:
(1) What is the Difference between Luminescence, Photoluminescence, Fluorescence, and Phosphorescence??-Edinburgh Instruments
(2) What is the difference between fluorescence, phosphorescence and luminescence?
(3) 小木虫
Bremsstrahlung (braking radiation)
中国老一辈发光科学家
徐叙瑢: